A vida sob pressão
Mais do que a falta de ar,
a pressão das águas é o grande obstáculo à permanência do homem no fundo do
mar, seja a 10 ou 300 metros, obrigando seu organismo a radicais adaptações ao
novo meio.
Sentado na
areia ardente à beira do mar, o homem fita a água e sonha em conquistar o azul
profundo. Há mais de 2000 anos, alguns ousados se aventuram a deixar a areia e
pulam de cabeça no mundo submarino — é quando descobrem que a
falta de ar não é o principal obstáculo a um passeio tranqüilo ao
lado de peixes e corais. O grande vilão das histórias debaixo d’água atende
pelo nome de pressão, um inimigo invisível, mortal, sub-reptício. Seja a 10 ou
a 100 metros de profundidade, quanto mais se desce, mais o oceano comprime os
frágeis corpos humanos, como se quisesse deliberadamente expulsá-los de um
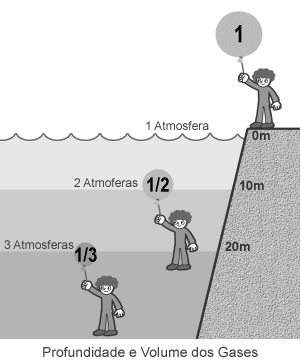
ambiente que não é seu. Com os pés em terra firme, o homem sofre a pressão de 1
atmosfera (1 quilo por centímetro quadrado do corpo, equivalente a uma coluna
de ar sobre a cabeça).
Como seu
organismo foi moldado pela evolução para viver nesse meio, o fardo é leve. Nos
domínios dos peixes, porém, o mundo fica mais pesado: a cada 10 metros na direção
do fundo do mar, a pressão aumenta em 1 atmosfera. No corpo humano apertado
pelo mar, o que sofre são as cavidades recheadas de ar, como os pulmões e os
ouvidos. A guerra do homem contra seu maior inimigo aquático, que pode deixar
como saldo alguns mortos e feridos, ainda que com pouca freqüência, começa
assim que se pula na água. Nem mesmo os praticantes do mergulho livre, a
modalidade mais simples e praticada com o equipamento mais básico, se vêem
livres de alguns percalços. Munido de máscara, snorkel (o canudinho para
respirar na superfície) e nadadeira, o mergulhador inspira fundo desce em
apnéia (com a respiração presa) e inicia sua aventura.
No caminho para
baixo, toda a lei de Boyle atrapalha. Ela diz que, em temperatura constante, o
volume de um gás é inversamente proporcional à pressão. Isso significa que,
apertado pela pressão crescente, o ar dentro da máscara vai diminuir de volume.
Se o mergulhador não injetar um pouco de ar na máscara pelo nariz, tornando
iguais as pressões do mar naquela profundidade e a do ar em sua máscara, a
estrutura elástica da borracha comprimirá seu rosto e surgirão hematomas.
As vítimas
seguintes são os ouvidos, apelidados, sem exagero, de calcanhar-de-aquiles do
mergulhador. “Uma região atrás do tímpano, chamada de ouvido médio, está cheia
de ar para funcionar como uma caixa acústica, com espaço para a vibração da
membrana do tímpano”, detalha o médico Paulo Iazzetti, professor e coordenador
da Unidade de Medicina Hiperbárica da Universidade de Campinas. “Justamente
por ser recheada de ar, esta região é vulnerável à variação
da pressão.” Iazzetti já era mergulhador com apenas 12 anos e enveredou
mais tarde pela Medicina Hiperbárica — ramo que surgiu para tratar
acidentados em mergulhos e que hoje é usada em diversas enfermidades.
Lazzetti
explica que, à medida que o mergulhador afunda, a pressão da água aumenta e
empurra o tímpano para dentro, provocando dor; se o mergulhador não tomar
nenhuma atitude, o tímpano poderá até se romper, causando o barotrauma do
ouvido médio Para evitar este tipo de acidente, o mergulhador realiza a manobra
de Valsalva, assim chamada por ter sido descrita por um fisiologista italiano
com esse nome: tapa-se o nariz com dois dedos, mantém-se a boca fechada e
expira-se com um pouco de força. Sem opção de saída, o ar caminha pela trompa
de Eustáquio, o canal membranoso que liga o ouvido à garganta, e chega ao
ouvido médio, preenchendo a cavidade e igualando a pressão de dentro com a de
fora. Caso a operação seja mal feita e o tímpano se rompa (o que só uma
delicada cirurgia resolve), a água fria entra no ouvido e pode atingir o
labirinto, responsável pelo equilíbrio do corpo.

“Se isto
acontecer, a vertigem pode confundir o nadador a ponto de ele não saber se está descendo
ou subindo” descreve outro médico mergulhador, Ivan Jorge Ribeiro, do
Centro Hiperbárico de São Paulo.
Nesse caso, há uma dica para localizar a superfície: seguir as bolhas de ar. “Elas,
sem dúvida nenhuma, estarão subindo”, brinca Ribeiro, carioca que recebeu o
apelido de Merluza em 1971, época de seu batismo na Marinha, no Rio de
Janeiro, e que hoje dá aulas para novatos civis em São Paulo. Se o mergulhador
cansar de ficar como ioiô afundando e buscando ar na superfície, e resolve
bater papo mais longo com os peixinhos, descobrirá que a aventura se complica a
cada metro em direção ao fundo. O mergulho autônomo, em que o mergulhador
carrega seu suprimento de ar num cilindro de aço ou alumínio, só virou
realidade quando o oceanógrafo francês Jacques Cousteau inventou o aqualung, em
1943.
O ar é “engarrafado” sob
uma pressão 200 vezes maior que a da atmosfera em terra firme. Uma válvula
acoplada ao cilindro reduz esta pressão para cerca de 8 atmosferas. Antes de o
ar atravessar o bocal e chegar até o mergulhador, porém, uma nova válvula reduz
a saída à mesma pressão da água naquela profundidade. “Desta maneira, quando o
ar é inspirado, está dando ao tórax uma pressão suficiente para que ele tenha
movimentação, vencendo a pressão que a água faz sobre o peito”, descreve
Vicente Albanez, professor de mergulho da academia Raia 4, em São Paulo.
Albanez já não ouve muito bem, resultado da pressão sob seu tímpano desde
o tempo em que resolveu fazer do mergulho sua profissão. Hoje, está empenhado
em divulgar o mergulho como terapia para crianças com deficiência mental.
O prazer de uma
fugaz estada no mundo aquático a bordo de um cilindro embute uma overdose de
moléculas gasosas. Como o ar dentro dele está comprimido sob alta pressão, a
quantidade de moléculas a ocupar o mesmo espaço é maior, aumentando
proporcionalmente a quantidade de gás absorvido pelo mergulhador. Ocorre então
uma saturação desses gases no organismo, que não está habituado a sorvê-los em
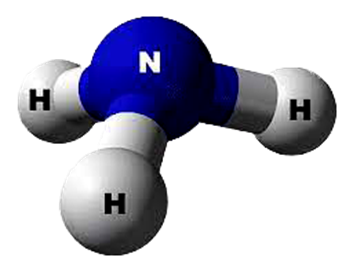
quantidades tão grandes. Como o ar atmosférico é composto de 78,62% de nitrogênio,
20,84% de oxigênio e 0,5% de outros gases, o aumento significativo do volume
inspirado vai resultar num problema igualmente grande para o mergulhador. O
nitrogênio praticamente não é metabolizado pelo organismo e se acumula, passa
dos alvéolos pulmonares para o sangue e do sangue para os tecidos, já que neles
a concentração deste gás em condições normais é mínima.
A dissolução do
nitrogênio no corpo não causa mal algum, mas na hora do caminho inverso — eliminar
o excesso — o gás dita as regras. Para se dosar a velocidade na qual
o mergulhador pode retornar à superfície sem problemas, a Marinha
americana desenvolveu uma tabela de descompressão, estruturada a partir da
profundidade que o mergulhador atingiu e o tempo que ele permaneceu submerso.
Em outras palavras, a tabela avalia a quantidade de gás inerte que teve tempo
de se instalar no organismo. Ela indica a velocidade com que se pode subir para
que o gás alojado tenha tempo de sair dos tecidos e ser eliminado pelas vias
aéreas — 18 metros por minuto e uma série de paradas, a 9, 6 e a 3
metros da superfície.
Quando a
pressão externa diminui, o gás faz o caminho inverso, dos tecidos para os
alvéolos, por difusão. Respeitada essa tabela, o risco diminui. Diminui mas não
acaba, porque o padrão que determina estes números é a resistência de um
marinheiro jovem, em boa forma física. Se o perfil do mergulhador não for
exatamente este, é recomendado não atingir os limites. O médico Paulo Iazzetti
explica que uma falha na hora de acompanhar estes números pode ocasionar a
chamada doença descompressiva: “Se você retorna à superfície,
onde a pressão é menor numa velocidade errada, o gás que estava dissolvido se
expande e forma microbolhas onde estiver.” É como o que acontece com
uma garrafa de Coca-Cola — quando aberta, a pressão dentro dela, que
era grande; diminui em contato com a atmosférica e o gás fisicamente diluído
desprende-se. Nos tecidos humanos, sem opção de fuga, as bolhas expandem-se no
lugar em que estão. Lazzetti conta que estas bolhas provocam dores nas
articulações, onde o tecido fibroso é uma porta aberta para a instalação destes
gases. Em casos mais graves, as microbolhas podem se alojar no cérebro, muito
vascularizado, onde, dependendo da localização, provocam danos algumas vezes
até fatais. A todo instante o mergulhador é lembrado de que é um intruso na
água. Uma distração ou um susto como avistar um tubarão, pode fazer com que ele
suba desesperado da pior maneira possível: com a respiração presa.

Se o
mergulhador prende a respiração, o gás se expande conforme a pressão diminui e
deforma o pulmão, provocando a temida embolia traumática pelo ar, que é rara,
mas pode acontecer em qualquer profundidade. “As moléculas de gás
expandidas forçam as paredes dos pulmões, o ar entra onde não era chamado, no
espaço entre o pulmão e a pleura, e colapsa a região”, descreve o médico Lazzetti. “Algumas
vezes pode haver até o rompimento dos pulmões, um quadro clínico muito grave e
difícil de ser tratado.” A maioria dos problemas com pressão podem ser
resolvidos colocando-se o mergulhador acidentado dentro de uma câmara
hiperbárica (do grego hypér, excesso, e báros, pressão), que o comprime e
depois diminui gradualmente a pressão, como numa volta segura à tona, para que
os gases que ele absorveu possam percorrer a via normal de retorno à atmosfera,
saindo da circulação para os pulmões e daí para a boca.
A partir dos 40
metros de profundidade, em média, o mergulhador também pode começar a “ver” sereias.
O mágico ilusionista, nada inocente, é de novo o nitrogênio. Uma vez
no organismo, o nitrogênio se instala na bainha de mielina, uma camada
gordurosa que envolve as células nervosas, e atrapalha a transferência de
cargas elétricas e o caminho do estímulo nervoso. O mergulhador tem então a
chamada narcose pelo nitrogênio, ou embriaguez das profundidades. Como se
estivesse bêbado, ele pode simplesmente esquecer de voltar à superfície ou ser
atraído para o fundo por um peixe espetacular. Neste momento, a presença de um
companheiro por perto ajuda o a salvar-se. No caso da narcose, subir devagar
ajuda a desalojar as bolhas de nitrogênio alojadas no sistema nervoso central.
Por todos estes percalços, uma regra em mergulho é lei: jamais mergulhar
sozinho.
A maioria dos
mergulhadores livres e autônomos gosta de enfrentar as aventuras submarinas por
esporte. Existem aqueles, porém, para quem o fundo do mar é um meio de vida. É
o caso dos mergulhadores profissionais das plataformas de exploração de
petróleo submarino, que descem a 300 metros de profundidade para manipular válvulas
nos oleodutos ou fazer reparos nos equipamentos. Executar o trabalho não é tão
complicado, o difícil é chegar lá. É preciso passar por um rosário de
adaptações para poder descer tão fundo, no chamado mergulho saturado, onde a
pressão ronda as 30 atmosferas— algo como 45 toneladas ou 56 fuscas sobre
os ombros.
O organismo do
mergulhador precisa ser lentamente comprimido, para equilibrar a pressão dos
gases de seu corpo com a escandalosa pressão na água àquela profundidade. “Se
isso não fosse feito, a pressão mecânica poderia esmagar os pulmões, romper os
tímpanos e até provocar sangramento nos seios da face, todos recheados por
ar” enumera o engenheiro Carlos Eduardo Serra, da Petrobrás responsável
pelo treinamento de mergulhadores.
“O primeiro
passo foi encontrar uma mistura gasosa que, sob alta pressão, não provocasse
efeitos colaterais no organismo.” Para o mergulho autônomo, onde. pela
lei, o mergulhador só pode ir até 40 metros, ar comprimido basta.
Mais fundo que isso, no mergulho dito saturado, a mistura de gases tal qual na
atmosfera poderia ser fatal.“Num mergulho profundo, a embriaguez seria
inevitável devido à alta pressão do gás respirado, que entra no organismo numa
velocidade muito maior”, compara o médico cardiologista Elmo de Araújo Carvalho
Júnior, da base naval de Mocanguê, em Niterói (RJ), onde mergulhadores são
treinados para trabalhar para a Petrobrás. Para resolver este problema, a
tática foi encontrar um gás mais leve, que substituísse o nitrogênio e não
tivesse o tal efeito narcótico. A solução foi trocá-lo pelo hélio, de peso
molecular menor, que sai dos tecidos de maneira mais fácil.
Parte do problema foi resolvido. Antes de descer ao mar para controlar o fluxo
de um oleoduto, por exemplo, o mergulhador entra num vaso de pressão instalado
no convés do navio e é comprimido com esta mistura chamada heliox (hélio mais
oxigênio) durante 24 horas.“Esta velocidade de compressão dos mergulhadores em
câmaras hiperbáricas éempírica”, admite Carvalho. “Eles eram
comprimidos gradualmente e, quando surgiam problemas, mudava-se a velocidade.” O
hélio, então aliado, eliminava o problema da hospedagem do gás nos tecidos, mas
não resolvia o dos tremores durante a compressão — uma doença chamada
síndrome neurológica das altas pressões, com sintomas semelhantes aos da
embriaguez somado a tremedeira, de aparecimento gradual e resultado direto da
velocidade de compressão. Arrumou-se, então, uma nova tática. Já que o
nitrogênio provoca a embriaguez atrapalhando o caminho dos impulsos elétricos
nas células nervosas, ele foi novamente colocado na mistura, mas em menor
quantidade.

Finalmente, o
mergulhador passou a ser colocado na câmara hiperbárica com uma mistura trimix — hélio,
oxigênio e 5% de nitrogênio — para não deixar que os tremores surjam. “O
nitrogênio na mistura funciona como uma dose de martini. Ele não fica
embriagado, e também não tem os tremores”.
Explica o
médico Carvalho. Neste mundo confinado, a vida do mergulhador depende de um
controle rigoroso das condições de seu novo lar, o vaso de pressão, não à toa
chamado de câmara de vida. O controle começa pela temperatura. “Uma das
características do gás hélio é a alta condutividade de calor”, explica Atílio
Vanin, químico da Universidade de São Paulo, que nunca mergulhou mas conhece
muito bem os caprichos dos gases. Dentro das câmaras, o hélio rouba calor de
seu vizinho — o homem a bordo.
Para contornar esse problema, a temperatura é mantida alta, em torno de 30º e
monitorada o tempo todo. Só que isso provoca uma acentuada desidratação do
mergulhador, que pode perder até 6 litros de água num só dia. Além de o aumento
da temperatura acelerar o metabolismo do corpo, os pulmões, habituados a sorver
ar com menor densidade, recebem um número muito maior de moléculas e são
obrigados a trabalhar mais. Isso leva a uma grande e constante perda de
energia.
Para compensar
todo este desgaste o cardápio oferecido é cerca de 50% mais rico em calorias do
que seria suficiente em condições normais de temperatura e pressão. Enquanto um
homem adulto se satisfaz com 2 248 calorias diárias, um mergulhador mantido sob
pressão precisa de 3 000, e ainda assim perde cerca de 10% de seu peso. Como se
não bastasse, o novo vilão hélio reaparece para estragar até esta única
diversão do dia — comer. A comida oferecida ao mergulhador que é passada
por meio de escotilhas, precisa ser muito temperada porque o hélio também
altera o paladar dos comensais. Na hora de trabalhar, afinal o objetivo de todo
este preparo, o mergulhador é levado até a profundidade desejada pelo braço de
um guindaste do convés do navio.
O transporte é
dentro de um sino, antes acoplado à câmara de vida. No sino, à mesma pressão da
câmara, descem dois mergulhadores com o equipamento necessário para a missão.
Uma vez na água, a 300 metros de profundidade longe dos raios solares, surge um
novo obstáculo: a temperatura no mar beira os 7°C, insuportável para o
mergulhador. A perda de calor é também muito rápida, pois a condutividade de
calor da água é 25 vezes maior que a do ar.
Para navegar
neste mundo gelado, sua roupa possui uma espécie de véu transpassado por
serpentinas, como as que esfriam chope, e é ligada ao sino por um cordão
umbilical. Água quente vinda diretamente do navio entra por estes tubos ocos,
passeia por todo o corpo e sai pelos pés, tudo para que o mergulhador não morra
de frio.Terminado o trabalho, os mergulhadores avisam o navio para trazê-los de
volta à superfície (na verdade, para a câmara de vida). Simples? Não. As cordas
vocais em movimento precisam do ar presente na laringe para a propagação das
ondas sonoras — em outras palavras, a voz. O hélio, que cobra muito
alto por seu uso nas câmaras hiperbáricas, provoca uma alteração cujo nome
descreve muito bem o que acontece: efeito Pato Donald.
A voz do mergulhador, que tem sua freqüência aumentada da baixa densidade do
hélio, parece mesmo a voz do famoso personagem dos desenhos animados. Entender
o recado dos mergulhadores só é possível com um indispensável aparelho
eletrônico que desmistura a voz, instalado no navio. Terminada a tarefa para a
qual foram escalados, e já instalados a bordo do navio, só então vai se iniciar
o lento retorno à “superfície”, ou a uma atmosfera de pressão.Para que o
hélio instalado no organismo dos mergulhadores possa sair, a pressão parcial
deste gás no ambiente precisa ser diminuída gradualmente. Assim, quando a
circulação sangüínea passa pelos alvéolos pulmonares e encontra ali uma baixa
concentração de hélio, já que a do ambiente está diminuindo, ele começa a bater
em retirada por difusão. Porém, se a queda de concentração de hélio não ocorrer
na mesma velocidade em que ele sai dos tecidos para a circulação, e da
circulação para os alvéolos, ocorre a tal doença descompressiva, com as suas
temidas microbolhas. Um mergulhador fica saturado pelos gases em
aproximadamente 12 horas de compressão.
.jpg)
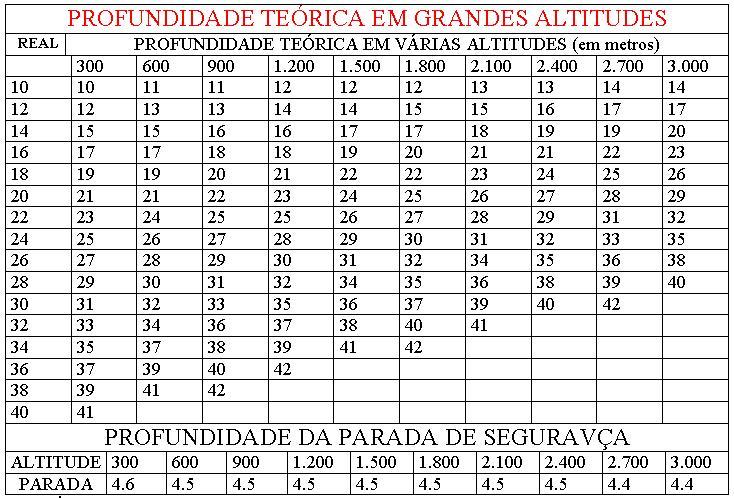
Assim, independentemente do tempo que permaneceu pressurizado, a descompressão
obedece à velocidade de um dia para cada 33 metros de profundidade, determinada
a partir da velocidade de saída do hélio dos tecidos. Se a lei permite que um
mergulhador fique apenas 28 dias pressurizado, conta-se um dia para a
compressão de mergulhos a 300 metros de profundidade, dezessete dias de
trabalho e outros dez somente para descomprimi-lo, sempre ilhado em câmaras. A
vida na clausura é difícil. “Sentimos o gás entrando, se instalando no
corpo, falamos como Pato Donald, emagrecemos, mas tudo isso dá para agüentar — o
mais importante é voltar para casa”, conta o mergulhador Sérgio
Moraes Brito, 30 anos, há oito trabalhando em plataformas petrolíferas.
Para impedir
que o mergulhador fique angustiado e queira voltar para casa pedido que levaria
no mínimo dez dias para ser atendido, os jornais fornecidos a ele são
previamente lidos. “Se ele mora num bairro do Rio de Janeiro que foi alagado
durante uma chuva forte, retiramos a notícia do jornal”, admite Elmo Carvalho,
da base naval de Mocanguê. No caso da Marinha, que possui câmaras para
instrução que simulam o mergulho, o médico e os auxiliares encarregados têm um
dossiê completo sobre o mergulhador, e tentam resolver seus problemas em terra. “Não é censura,
mas também não ia ajudar nada ele ficar sabendo”, justifica-se Carvalho. De
qualquer forma, toda essa complicada operação de levar um mergulhador ao fundo
do mar deve desaparecer logo. Os mergulhadores estão sendo substituídos por
robôs, que não têm família em terra nem o menor problema em enfrentar a brutal
pressão das águas.
Material Interessante,
que expressa o quanto devemos ser analíticos em diversos segmentos, toda a analítica
é cabível, ao se tratar em tolerância, proporção, grandeza e segmento.
Como tal
devemos adotar um olhar mais crítico quanto a nossa realidade e meio.
Tenho dito !

























.jpg)